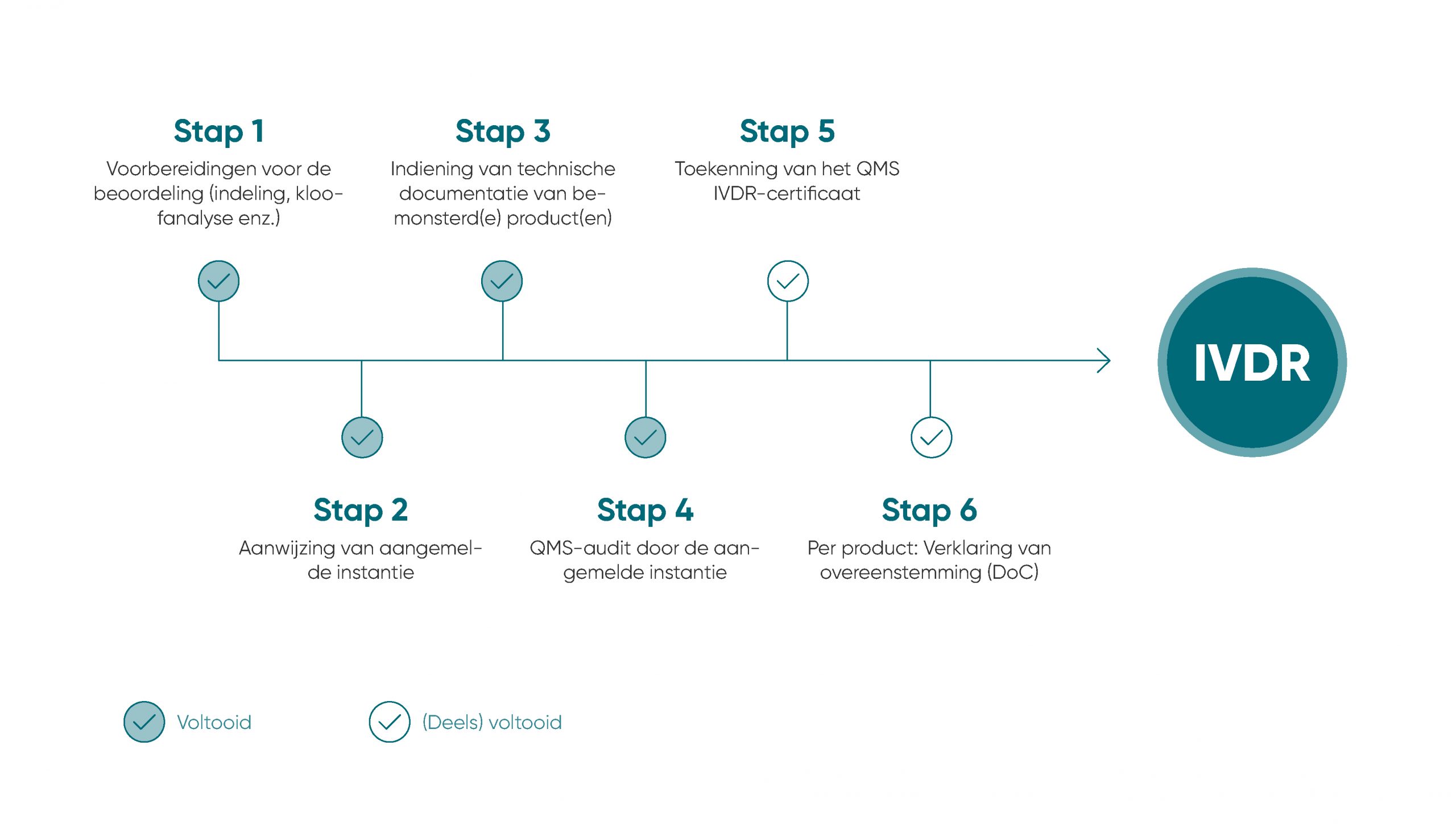
De EU heeft een nieuw juridisch kader gecreëerd voor de kwaliteit en veiligheid van in-vitro medische hulpmiddelen, de IVDR (Verordening betreffende medische hulpmiddelen voor in-vitrodiagnostiek); die legt voor alle EU-lidstaten bindende en strengere normen op vanaf mei 2022. Eerst en vooral zal deze verordening de klinische veiligheid van medische hulpmiddelen voor in-vitrodiagnostiek verbeteren en een uniforme rechtsgrondslag vastleggen voor alle fabrikanten.
De belangrijkste elementen ervan zijn strengere eisen voor documentatie, klinisch bewijs en beoordeling van de overeenstemming, alsook transparantie en traceerbaarheid nadat producten op de markt zijn gebracht. Met deze certificering bewijzen fabrikanten dat ze voldoen aan de hoogste kwaliteits- en veiligheidsnormen, en dat ze gebruikmaken van een doeltreffend risicobeheersysteem.
Aangezien kwaliteit altijd al een cruciale kwestie was voor R-Biopharm, kan het garanderen dat het de IVDR-bepalingen voor 100% naleeft en dat het aanzienlijke middelen inzet om toe te zien op de complete invoer van deze verordening. Met ons uitgebreid kwaliteitsbeheersysteem kunnen we op ieder moment de naleving en toepassing van de strengste normen en voorschriften waarborgen, van de ontwikkeling van producten tot hun gebruik. Op die manier wordt de kwaliteit constant verhoogd, zodat we op de lange termijn betrouwbare en hoogwaardige producten kunnen aanbieden voor de gezondheid van consumenten en patiënten.
R-Biopharm zal dit ook in de toekomst vastberaden blijven doen en nieuwe uitdagingen blijven aangaan, aangezien het gaat om een van zijn fundamentele waarden. Uiteraard zijn de overgangsperioden verlengd: productinnovaties moeten vanaf 26 mei 2022 aan de nieuwe voorschriften voldoen, terwijl dit voor bestaande producten uit verschillende klassen enkel geldt vanaf het einde van mei 2025 (producten uit klasse D), 2026 (klasse C) en 2027 (klasse A-steriel en B). De invoer van de IVDR-eisen zal echter een topprioriteit blijven bij R-Biopharm.